
こんにちは、minoariです。 急性期看護師歴30年のオツボネナースが、**もう一度、基本に立ち返って**血ガスのポイントを整理してみました。
📘 第1章では「アシデミア」について、
📘 第2章では「CO₂がたまって酸性に傾く=呼吸性アシドーシス」について、
図解を交えてお話してきました。
でも実は、呼吸とはまったく関係ない酸もあるんです。
それが、乳酸・ケトン体・リン酸・硫酸などの「非揮発性酸」。
第1章でも少しふれましたね。
こうした非揮発性酸が体にたまると、呼吸ではどうにもできない「代謝性アシドーシス」が起こります。
第3章では、呼吸ではどうにもできない“もうひとつの酸性化”=代謝性アシドーシスについて、
重炭酸イオンとの関係やアニオンギャップの秘密についても優しく紐解いていきます。
⚠️ 本記事は、看護師としての学び直しを目的とした個人的な覚え書きです。 医療的判断や処置を行う際は、必ず医師や専門家の指示を仰いでください。

💭 重炭酸イオン!?
アニオンギャップ!?
…ってなってます?
大丈夫! 解決しますよ~👍
では本章へ入っていきまーす!
📖 第3章:HCO₃⁻とpHの関係 ― 代謝性アシドーシスとは?
🔸非揮発性酸ってなに?
まず、CO₂のように呼吸で排出できる酸を「揮発性酸」と呼びます。これに対して、呼吸では出せない酸のことを「非揮発性酸」といいます。
代表的な非揮発性酸は
- 乳酸(ショックや低酸素で増える)
- ケトン体(糖が使えないときに脂肪代謝で出現)
- リン酸・硫酸(タンパク質の代謝産物)
- 薬物・毒物(メタノール、アスピリンなど)
これらは肺から出せないため、腎臓やHCO₃⁻(重炭酸)が対応する必要があります。
ここでもう一度揮発性酸と非揮発性酸の違いの表をみてみましょう
| 酸の種類 | 代表例 | 排出経路 | 調整器官 |
|---|---|---|---|
| 揮発性酸 | CO₂ | 呼吸 | 肺 |
| 非揮発性酸 | 乳酸、ケトン体、リン酸、硫酸、毒物 | 腎排泄+HCO₃⁻緩衝 | 腎臓 |

どうですか
1章で見たこの表 📊
2章を経て 📖
3章でみると 👀
かなりイメージついてるはず!
🔸 HCO₃⁻が減ることでpHが下がるメカニズム(代謝性アシドーシス)
代謝性アシドーシスは、「酸が増えてHCO₃⁻が失われる」ことで起こります。
原因からpH低下までの流れを整理してみましょう。
- 体内代謝が上手くいかず何らかの酸(非揮発性酸)が体内に溜まる
- H⁺(水素イオン)が増加している状態
- H⁺を中和するために HCO₃⁻ と結合
- HCO₃⁻ が減少し(塩基が減る)、pHが下がる
- →これが代謝性アシドーシス

🧪 酸が増えるってことは、H⁺が増えるってこと
それを中和するためにHCO₃⁻が使われていくんだよ!
📌補足:この流れは、血液ガスの基礎である Henderson–Hasselbalch 式(ヘンダーソン・ハッセルバルク式) につながります。
…って言われても、
「知らんがな 😂」って感じかもしれませんが、実は臨床で血ガスを読むときには 必ずこの式と私たちは出会っているみたい。
ここでは Henderson–Hasselbalch 式そのものは紹介しませんが、pHは「腎臓の働き(HCO₃⁻)」と「呼吸の働き(PaCO₂)」のバランスで決まるということ
🔸代謝性アシドーシスが起こる臨床の場面
ではここからは、代謝性アシドーシスが起きる主な疾患とその特徴を表で整理してみましょう👇
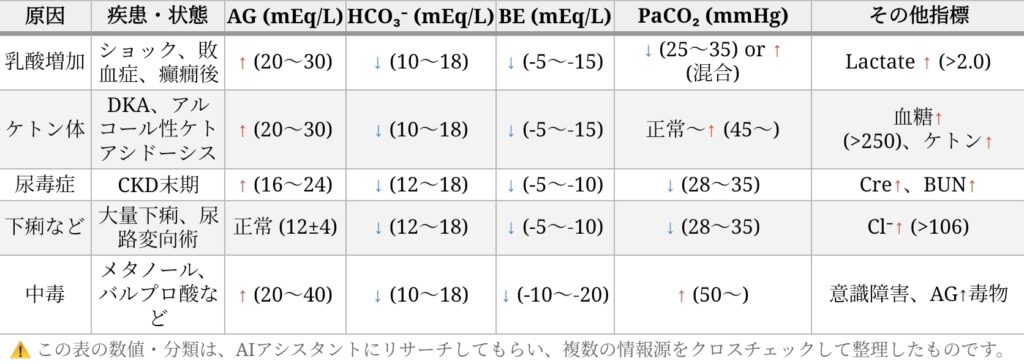
- AG:アニオンギャップ(酸の過不足をみる指標)
- BE:ベースエクセス(代謝性アシドーシスの重症度をみる指標)
- PaCO₂:動脈血中二酸化炭素分圧(呼吸の働きを反映)
- HCO₃⁻:重炭酸イオン(腎臓で調整される緩衝物質)

ここで特に大事なのが AG(アニオンギャップ)!
酸の過不足をチェックする指標として
代謝性アシドーシスの鑑別に欠かせないんだよ。
🔸アニオンギャップ(AG)ってなに?
血中の電解質って、実は 「陽イオン=陰イオン」でつり合ってるんです。
でも見かけ上は、Na⁺ − (Cl⁻ + HCO₃⁻) の差分(ギャップ)がある。
このギャップこそが、見えない陰イオン(=乳酸、ケトン体、毒物など)を示しているのです。
そしてこの差分を示すのが AG(アニオンギャップ)!
AGの計算式:AG = Na⁺ − (Cl⁻ + HCO₃⁻)
🔹 正常値:12 ± 4 mEq/L(施設によって基準に差あり)

AGが上がってるときは、
“見えない酸”がある
可能性があるってことよ〜!
📌補足:AGが正常でも起こる代謝性アシドーシスがあるよ
・・・<代表例>Cl⁻が増えることによって起こるアシドーシス(高Cl⁻性アシドーシス)
👉 大量下痢、尿路変向術など
🔸 血ガスでどう見る?(代謝性アシドーシス)
血ガスを読むときは、まず pH・PaCO₂・HCO₃⁻・AG の順にチェック。どこに変化があるかで、「どんなタイプのアシドーシスか」を見分けていきます。
- pH:7.35未満? → アシデミアあり
- PaCO₂:45mmHg以下? → 呼吸性じゃないな
- HCO₃⁻:18mEq/L以下? → 代謝性だな
- AG:上昇?正常? → 高AG型か、正常AG型かを見分ける
- 「代謝性アシドーシスの特徴の表」の「その他の指標」を見て、原因をつきとめる。
パターンで言うと:
- 高AG型代謝性アシドーシス(乳酸・ケトン・中毒など)HCO₃⁻↓+AG↑(>20) → 代表例:乳酸アシドーシス、DKA、腎不全、中毒
- 正常AG型代謝性アシドーシス(下痢・RTAなど) → HCO₃⁻↓+AG正常(8〜16) → 代表例:下痢、尿路変向、RTA
📌 ポイント:HCO₃⁻の低下でまず「代謝性」を疑い、AGを見て「高AG型」か「正常AG型」かを判断する。

🩺 pHが下がってるのに CO₂ はたまっていない…
そんなときは HCO₃⁻ と AG をチェック!
💡代謝性アシドーシスかも!?

第1章~3章までで
“身体か酸っぱい状態”
理解できましたか?
🧭 次章では、
「酸が多い世界」から反対側、塩基が多い世界=アルカレミア、そしてアルカローシスを見ていきます。pHが高いとき、体の中では何が起こるのか?その仕組みを一緒に整理していきましょう🩺



コメント